
As moléculas são coesas mesmo que sua capacidade de formar ligações químicas tenha sido satisfeita. A evidência da existência dessas forças é o fato de que gases podem ser liquefeitos, que existem líquidos comuns e precisam de uma entrada considerável de energia para a vaporização de um gás de moléculas independentes, e que muitos compostos moleculares ocorrem como sólidos. O papel das forças intermoleculares fracas nas propriedades dos gases foi examinado pela primeira vez teoricamente pelo cientista holandês Johannes van der Waals, e o termo “As forças de van der Waals” é usado como sinônimo de forças intermoleculares. Sob certas condições, aglomerados fracamente ligados de moléculas (como um átomo de argônio em associação com uma molécula de cloreto de hidrogênio) podem existir; tais espécies delicadamente ligadas são chamadas moléculas de van der Waals.
Existem muitos tipos de forças intermoleculares; a força repulsiva e quatro variedades de força atrativa são discutidas aqui. Em geral, a energia de interação varia com a distância, como mostra o gráfico da Figura 16 . Forças atrativas dominam a distância em que as duas moléculas entram em contato, então fortes forças repulsivas entram em ação e a energia potencial de duas moléculas aumenta abruptamente.
Força Repulsiva
A parte repulsiva do potencial intermolecular é essencialmente uma manifestação da sobreposição das funções de onda das duas espécies em conjunção com o princípio de exclusão de Pauli. Reflete a impossibilidade de elétrons com o mesmo giro ocuparem a mesma região do espaço. Mais rigorosamente, o aumento acentuado na energia é ilustrado pelo comportamento de dois átomos de hélio e sua posse da configuração 1σ 2 2σ 2 ( ver acima Figura 13). O efeito antiligante do orbital de energia superior domina o efeito de ligação do orbital 1σ em todas as separações, e a energia do primeiro se eleva mais rapidamente do que a do último. Consequentemente, à medida que a separação internuclear é diminuída, a energia total aumenta acentuadamente. Todas as espécies de conchas fechadas se comportam de maneira semelhante pelo mesmo motivo.

Interação Dipolo – dipolo
A primeira das quatro interações de ligação discutidas aqui é a interação dipolo-dipolo entre moléculas polares. Deve ser lembrado que uma molécula polar tem um momento de dipolo elétrico em virtude da existência de cargas parciais em seus átomos. Cargas parciais opostas se atraem e, se duas moléculas polares são orientadas de modo que as cargas parciais opostas nas moléculas estejam mais próximas umas das outras do que suas cargas similares, então haverá uma atração líquida entre as duas moléculas. Este tipo de força intermolecular contribui para a condensação de cloreto de hidrogênio a um líquido a baixas temperaturas. A interação dipolo-dipolo também contribui para a fraca interação entre moléculas nos gases, porque, embora as moléculas girem, elas tendem a permanecer em orientações relativas nas quais elas têm baixa energia – a orientação mútua com cargas parciais opostas próximas umas das outras.
Interação Dipolo-induzido-dipolo
O segundo tipo de interação atraente, o interação dipolo-induzida-dipolo, também depende da presença de uma molécula polar. A segunda molécula participante não precisa ser polar; mas, se é polar, essa interação aumenta a interação dipolo-dipolo descrita acima. Na interação dipolo-induzido-dipolo, a presença das cargas parciais da molécula polar causa uma polarização, ou distorção, da distribuição de elétrons da outra molécula. Como um resultado desta distorção, a segunda molécula adquire regiões de positivo e negativo parcial taxa e, assim, torna-se polar. As cargas parciais assim formadas se comportam exatamente como as de uma molécula permanentemente polar e interagem favoravelmente com suas contrapartes na molécula polar que originalmente as induziram. Portanto, as duas moléculas são coesas. Essa interação também contribui para as forças intermoleculares responsáveis pela condensação do gás cloreto de hidrogênio.

Interação de Dispersão
O terceiro tipo de interação atua entre todos os tipos de moléculas, polares ou não. É também um pouco mais forte do que as duas interações atraentes discutidas até agora e é a principal força responsável pela existência das fases condensadas de certas substâncias moleculares, como benzeno, outros hidrocarbonetos, bromo e os elementos sólidos fósforo (que consiste em tetraedros P 4moléculas) e enxofre (que consiste em S 8 em forma de coroa moléculas). A interação é chamada interação de dispersão ou, menos comumente, mas mais revelador, a interação dipolo induzido-induzido-dipolo. Considere duas moléculas não polares próximas umas das outras. Embora não haja cargas parciais permanentes em nenhuma molécula, a densidade eletrônica pode ser considerada incessantemente flutuante. Como resultado dessas flutuações, regiões de carga parcial igual e oposta surgem em uma das moléculas e dão origem a um dipolo transitório. Este dipolo transitório pode induzir um dipolo na molécula vizinha, que então interage com o dipolo transiente original. Embora este último pisque continuamente de uma direção para outra (com uma média de zero dipolo em geral), o dipolo induzido o segue, e os dois dipolos correlacionados interagem favoravelmente entre si e coesos.
Ligação de Hidrogênio
As interações descritas até agora não estão limitadas a moléculas de qualquer composição específica. No entanto, há uma interação intermolecular importante específica para moléculas contendo um oxigênio, azoto ou átomo de flúor que está ligado a um átomo de hidrogênio. Essa interação é a ligação de hidrogênio, uma interação da forma A – H ··· B, onde A e B são átomos de qualquer um dos três elementos mencionados acima e o átomo de hidrogênio se encontra em uma linha reta entre os núcleos de A e B. Uma ligação de hidrogênio é cerca de 10 vezes mais forte que as outras interações descritas acima e, quando presente, domina todos os outros tipos de interação intermolecular. É responsável, por exemplo, pela existência de água como um líquido a temperaturas normais; por causa de sua baixa massa molar, seria esperado que a água fosse um gás. A ligação de hidrogênio também é responsável pela existência como sólidos de muitas moléculas orgânicas contendo grupos hidroxila (―OH); os açúcares glicose e sacarose são exemplos.
Muitas interpretações da ligação de hidrogênio foram propostas. Um que se encaixa no esquema geral deste artigo é a pensar na unidade A-H como sendo composto por um A orbital atômica e um átomo de hidrogênio 1 s orbital e considerar um par solitário de elétrons em B como ocupando um orbital B. Quando os três átomos estão alinhados, esses três orbitais podem formar três orbitais moleculares: um ligante, um amplamente não-ligante e um antiligante. Há quatro elétrons para acomodar (dois da ligação A H original e dois do par solitário). Eles ocupam os orbitais bonding e nonbonding, deixando o orbital antibonding vago. Assim, o efeito líquido é diminuir a energia do agrupamento AHB e, assim, constituir uma ligação intermolecular. Mais uma vez, ao encontrar a ligação de hidrogênio, encontramos uma reviravolta na atitude convencional; a questão levantada por essa interpretação não é por que tal vínculo ocorre, mas por que não ocorre de maneira mais geral. A explicação está no pequeno tamanho do átomo de hidrogênio, que permite que o equilíbrio de energias no esquema orbital molecular seja favorável à ligação.
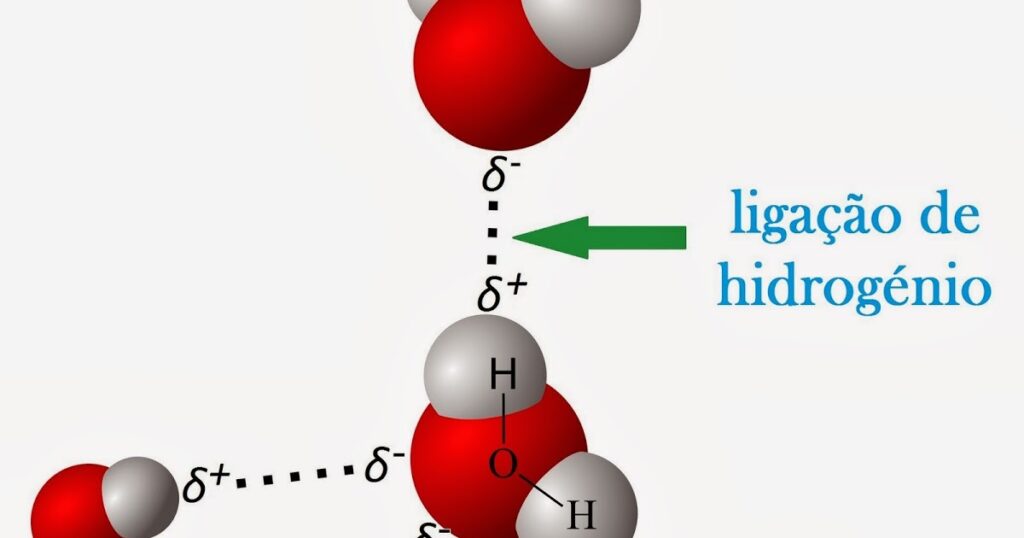
A ligação de hidrogênio ocorre com átomos diferentes de nitrogênio, oxigênio e flúor se eles carregam uma carga negativa e, portanto, são ricos em elétrons prontamente disponíveis. Assim, a ligação de hidrogênio é um dos principais mecanismos de hidratação de ânions em solução aquosa (a ligação de moléculas de H 2 O à espécie de soluto) e, portanto, contribui para a capacidade da água de atuar como um bom solvente para compostos iônicos. Também contribui para a hidratação de compostos orgânicos contendo átomos de oxigênio ou nitrogênio e, portanto, é responsável pela maior solubilidade aquosa de álcoois do que hidrocarbonetos.
As ligações de hidrogênio são de grande importância na determinação da estrutura de compostos biologicamente significativos, mais notadamente proteínas e ácido desoxirribonucleico (DNA). Uma característica importante da estrutura das proteínas (que são polipeptídeos, ou polímeros formados a partir de aminoácidos ) é a existência da ligação peptídica, o grupo ―CO ― NH―, que aparece entre cada par de aminoácidos adjacentes. Esta ligação proporciona um grupo NH que pode formar uma ligação de hidrogênio para um átomo aceitador adequado e um átomo de oxigênio, que pode atuar como um receptor adequado. Portanto, uma ligação peptídica fornece os dois ingredientes essenciais de uma ligação de hidrogênio. A junção de tais grupos peptídicos por ligação de hidrogênio do tipo mostrado na Figura 17 foi examinada em detalhe por Pauling e Robert Corey, que formulou um conjunto de regras, as Regras de Pauling-Corey, para a sua implementação. A implicação destas regras é a existência de dois tipos de estrutura para um polipéptido, que é uma forma helicoidal (a hélice α) ou uma forma de folha plissada (a folha plissada). Todos os polipéptidos têm uma estrutura ou outra e têm frequentemente regiões alternadas de cada um. Uma vez que as propriedades e o comportamento de uma molécula de enzima (uma classe particular de polipeptídeos) são determinados pela sua forma e, em particular, pela forma da região onde a molécula em que atua precisa anexar, segue-se que as ligações de hidrogênio são de importância central. às funções da vida.
As ligações de hidrogênio também são responsáveis pela transmissão de informações genéticas de uma geração para outra, pois elas são responsáveis pela codificação específica da citosina com guanina e timina com moléculas de adenina que caracterizam a estrutura da dupla hélice do DNA.

Variedades de Sólidos
Ligações químicas e forças intermoleculares são conjuntamente responsáveis pela existência das fases sólidas da matéria. Esta seção revisa alguns dos tipos de sólidos encontrados e os relaciona aos tópicos discutidos anteriormente.
Sólidos Iônicos
As estruturas de sólidos iônicos já foram descritas com algum detalhe. Eles consistem em íons individuais que são empilhados juntos de forma que o conjunto tenha a energia mais baixa possível. Esses íons podem ser monoatômicos (como o cloreto de sódio, que consiste em íons Na + e Cl – ) ou os próprios íons podem ser espécies poliatômicas ligadas por covalência. Um exemplo deste último é nitrato de amônio, no qual o cátion é NH 4 + e o ânion é NO 3 – ; as ligações N − H e N − O dentro dos íons são covalentes. Os compostos iônicos são geralmente duros e frágeis e possuem altos pontos de fusão.
Sólidos Moleculares
As estruturas de sólidos moleculares, que são sólidos compostos de moléculas individuais, também foram tocadas na seção sobre forças intermoleculares. Essas moléculas são mantidas uma na outra por ligações de hidrogênio (se puderem formar), forças de dispersão e outras forças dipolares – nessa ordem de importância decrescente – e as moléculas se juntam em um padrão que minimiza sua energia total. Exemplos de tais sólidos incluem gelo, em que a ligação de hidrogênio é de suma importância, e polietileno, no qual as forças de dispersão são dominantes. A menos que estejam presentes ligações de hidrogênio (em cujo caso os sólidos moleculares se assemelham a sólidos iônicos na fragilidade), os sólidos moleculares são geralmente moles e possuem baixos pontos de fusão, porque as ligações entre as moléculas são facilmente superadas.

Sólidos de Redes
Existe uma classe de sólidos chamada sólidos de rede na qual a ligação é essencialmente devida a uma rede de ligações covalentes que se estende por todo o sólido. Esses sólidos são duros e rígidos e possuem altos pontos de fusão, porque o cristal é como uma enorme molécula. O exemplo mais conhecido de um sólido de rede é diamante, que consiste em átomos de carbono tetraédrico ( ver Figura 7 ). Em virtude da rigidez de sua estrutura de ligação, o diamante é a substância mais dura conhecida e também o melhor condutor de calor.
Alguns sólidos têm um caráter de rede em certas direções e um caráter mais molecular em outras direções. Mais uma vez, o carbono fornece o exemplo paradigmático, para a forma de carbono conhecida como grafite consiste em uma pilha de folhas de anéis hexagonais de átomos de carbono. No plano das folhas, a ligação é covalente (e se assemelha a uma versão estendida da ligação em benzeno). As folhas em si são unidas por encadernação tão fraca que às vezes é chamada de interação van der Waals. A anisotropia da estrutura da grafite explica a anisotropia de sua condutividade elétrica (que é mais alta no plano das folhas do que perpendicular a elas). A capacidade do grafite de lançar folhas de carbono (um recurso utilizado na fabricação de lápis) e de agir como um lubrificante de alta temperatura (porque as folhas podem deslizar umas sobre as outras) parece ser consistente com essa estrutura, mas na verdade parece dependem da presença de impurezas entre as folhas.
Metais
O restante tipo principal de sólido é um metal. Um metal é caracterizado por seu brilho, a facilidade com que ele pode ser deformado (em vez de quebrado) por martelamento e suas altas condutividades elétricas e térmicas. Metais também tendem a ter densidades mais altas que outros tipos de sólidos. O ponto de partida para as teorias das estruturas dos metais é considerá-las como consistindo de cátions dos átomos de metal embutidos em um mar formado pela valência descartada A mobilidade desses elétrons é responsável pelas propriedades mecânicas, ópticas e elétricas dos metais. Os cátions esféricos podem se agrupar juntos, mas ainda assim dar origem a conjuntos elétricos localmente neutros. Isso é devido à capacidade dos elétrons se espalharem entre os cátions e neutralizarem suas cargas, independentemente de quão próximos estejam. A proximidade da embalagem dos átomos responde pelas altas densidades de metais.

No contexto das teorias da ligação química, um metal é uma molécula homonuclear extremamente grande. Se uma amostra de sódio de metal é pensado como consistindo de n átomos de sódio em que cada átomo tem um 3 s orbital para utilização na construção de orbitais moleculares e cada átomo suprimentos um electrão para uma piscina comum, em seguida, a partir destes N orbitais n orbitais moleculares pode ser construído . Cada orbital tem uma energia característica, e a faixa de energias abrangida pelos n orbitais é finita, por maior que seja o valor de n . Se n for muito grande, resulta que a energia de separação entre orbitais moleculares vizinhos é muito pequeno e se aproxima de zero como nse aproxima do infinito. Os orbitais moleculares formam uma faixa de energias. Outra banda semelhante pode ser formada pela sobreposição das 3 p orbitais dos átomos, mas existe uma substância de banda proibida- uma região de energia na qual não há orbitais moleculares – entre as duas bandas.
Embora a 3 s banda é praticamente contínuo, que consiste na realidade de n orbitais moleculares discretas, cada uma das quais, pelo princípio de exclusão de Pauli, podem conter dois electrões emparelhados. Segue-se que a faixa de sódio de 3 s , que é ocupada pelo conjunto de n elétrons, está apenas pela metade. Há orbitais moleculares vazios imediatamente acima dos orbitais mais altos, e é fácil para uma perturbação, como uma diferença de potencial aplicada ou um campo eletromagnético oscilante da luz incidente, mover os elétrons para esses níveis desocupados. Assim, os elétrons são muito móveis e podem conduzir uma corrente elétrica, reflita a luz, transmita energia e migre rapidamente para novos locais quando os cátions são movidos por martelamento.
A teoria completa da estrutura dos metais é um assunto altamente técnico (assim como as teorias completas dos outros tópicos discutidos aqui). Esta breve introdução foi destinada apenas a mostrar que as idéias da teoria orbital molecular podem ser naturalmente estendidas para dar conta das características gerais das estruturas e propriedades dos sólidos.


