
A Lei de Hess, afirma que, independentemente dos múltiplos estágios ou etapas de uma reação, a mudança total de entalpia para a reação é a soma de todas as mudanças. Esta lei é uma manifestação de que a entalpia é uma função do estado.
A Lei de Hess tem o nome do químico russo e do doutor Germain Hess. Hess ajudou a formular os primeiros princípios da termoquímica. Seu trabalho mais famoso, publicado em 1840, incluiu sua lei sobre a termoquímica. A lei de Hess se deve ao fato de a entalpia ser uma função de estado, o que nos permite calcular a mudança geral na entalpia simplesmente resumindo as mudanças para cada etapa do caminho, até que o produto seja formado. Todas as etapas devem prosseguir na mesma temperatura e as equações das etapas individuais devem ser equilibradas. O princípio subjacente à lei de Hess não se aplica apenas à Entalpia e pode ser usado para calcular outras funções do estado, como mudanças na energia e entropia de Gibbs.

Esta lei estabelece que, se uma reação ocorre em várias etapas, a entalpia padrão da reação para a reação global é igual à soma das entalpias padrão das etapas intermediárias da reação, assumindo que cada etapa ocorre na mesma temperatura.
A lei de Hess deriva diretamente da lei de conservação de energia, bem como sua expressão na primeira lei da termodinâmica. Como a entalpia é uma função de estado, a mudança na entalpia entre produtos e reagentes em um sistema químico é independente da trajetória do estado inicial até o final do sistema. A lei de Hess pode ser usada para determinar a energia geral necessária para uma reação química, especialmente quando a reação pode ser dividida em várias etapas intermediárias que são individualmente mais fáceis de caracterizar. A mudança de entalpia negativa para uma reação indica um processo exotérmico, enquanto a mudança positiva de entalpia corresponde ao processo endotérmico.

Reações Químicas
A maioria das reações químicas é na verdade uma série de reações. Tomemos por exemplo a decomposição do açúcar em energia:
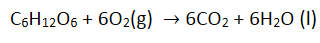
Isso realmente ocorre em dezenas de etapas. A glicose é primeiro transformada em glicose-6-fosfato e, eventualmente, em piruvato e, em seguida, em dióxido de carbono. Alguns dos elétrons são colocados no ADP para produzir ATP. Quando esses elétrons são removidos para energia, o oxigênio é usado. Durante todo esse processo, acabamos perdendo água. Mas é muito mais fácil e mais eficiente simplificá-lo em uma única reação. Tudo o que acaba sendo um produto e reagente é cancelado até que acabamos com açúcar e oxigênio como reagentes, e dióxido de carbono e água como produtos.
Vamos ver um exemplo simples usando A e B. Vamos dizer que:
A + B = AB
e
AB + C = ABC
Então podemos dizer que A + B + AB + C = AB + ABC. Mas como AB é tanto um produto quanto um reagente, podemos cancelá-los e simplificá-lo ainda mais em A + B + C = ABC.

Isso não apenas facilita escrever fórmulas químicas. Também simplifica o processo de determinação da mudança total de entalpia. A lei de Hess afirma que, independentemente dos múltiplos passos ou intermediários em uma reação, a mudança total de entalpia é igual à soma de cada reação individual. Também é conhecido como a conservação da lei de energia. Então, isso significa que podemos determinar a mudança total de entalpia de A + B + C = ABC determinando a mudança de entalpia dessa reação real. Ou, podemos determinar a mudança de entalpia para A + B = AB e AB + C = ABC e, em seguida, adicionar esses dois juntos.
Outra maneira de ver isso é com um gráfico. Digamos que é preciso muita energia para A e B formarem AB. Mas então, uma vez que combina com C no ABC, libera muita energia:
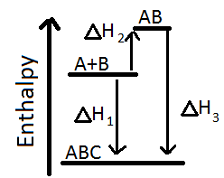
Assim, podemos determinar a mudança de entalpia simplesmente olhando para o delta H1, ou podemos adicionar o delta H2 e o delta H3. Isso pode não fazer sentido no começo. Por que adicionaríamos delta H2 e delta H3 em vez de subtrair o delta H2 do delta H3? Mas precisamos lembrar que o delta H1 e delta H3 são negativos (porque eles caem no gráfico de entalpia) enquanto o delta H2 é positivo (porque sobe no gráfico de entalpia), então a adição e a subtração já são trabalhadas fazendo os números são positivos ou negativos.
A Lei de Hess está dizendo que se você converter os reagentes A em produtos B, a mudança geral de entalpia será exatamente a mesma, seja em uma ou duas etapas ou em quantas etapas.
Se você observar a mudança em um diagrama de entalpia, isso é bastante óbvio.

Isto mostra as mudanças de entalpia para uma reação exotérmica usando duas maneiras diferentes de ir dos reagentes A aos produtos B. Em um caso, você faz uma conversão direta; no outro, você usa um processo de duas etapas envolvendo alguns intermediários.
Em ambos os casos, a mudança global de entalpia deve ser a mesma, porque é governada pelas posições relativas dos reagentes e produtos no diagrama de entalpia.
Se você for através dos intermediários, você tem que colocar alguma energia térmica extra para começar, mas você a recupera no segundo estágio da seqüência de reações.
No entanto muitos estágios a reação é feita, em última análise, a mudança de entalpia global será a mesma, porque as posições dos reagentes e produtos em um diagrama de entalpia será sempre o mesmo.

Quem Foi Germain Hess?
Germain Henri Hess (nascido em 7 de agosto de 1802, Genebra , Switz – falecido em 30 de novembro de 1850, São Petersburg , Rússia) foi um químico cujos estudos de calor em reações químicas formaram a base da termoquímica.
Depois de praticar medicina por vários anos em Irkutsk, na Rússia, Hess tornou-se professor de química em 1830 no Instituto Tecnológico da Universidade de São Petersburgo. Suas primeiras investigações foram sobre minerais e o gás natural encontrado perto de Baku. Ele descobriu a oxidação de açúcares para produzir ácido sacárico e em 1834 publicou um trabalho sobre química que se tornou um texto padrão na Rússia por muitos anos.
Em 1840, Hess anunciou a lei da soma de calor constante, também conhecida como A lei de Hess, que afirma que a quantidade de calor envolvida na produção de um produto químico de outro é sempre a mesma, não importa quantas etapas sejam tomadas para obter o produto desejado. A lei de Hess anunciava a formulação da lei mais completa de conservação de energia e preparou o caminho para o desenvolvimento de produtos químicos.


