
A geometria molecular, também conhecida como estrutura molecular, é a estrutura ou disposição tridimensional dos átomos de uma molécula. Entender a estrutura molecular de um composto pode ajudar a determinar a polaridade, a reatividade, a fase da matéria, a cor, o magnetismo e a atividade biológica.
Para determinar as formas das moléculas, devemos nos familiarizar com a estrutura de elétrons de Lewis. Embora a teoria de Lewis não determine as formas das moléculas, é o primeiro passo na previsão de formas de moléculas. A estrutura de Lewis nos ajuda a identificar os pares de ligação e os pares solitários. Então, com a estrutura de Lewis, aplicamos a teoria de repulsão de pares de elétrons da camada de valência (VSEPR) para determinar a geometria molecular e a geometria do grupo de elétrons.
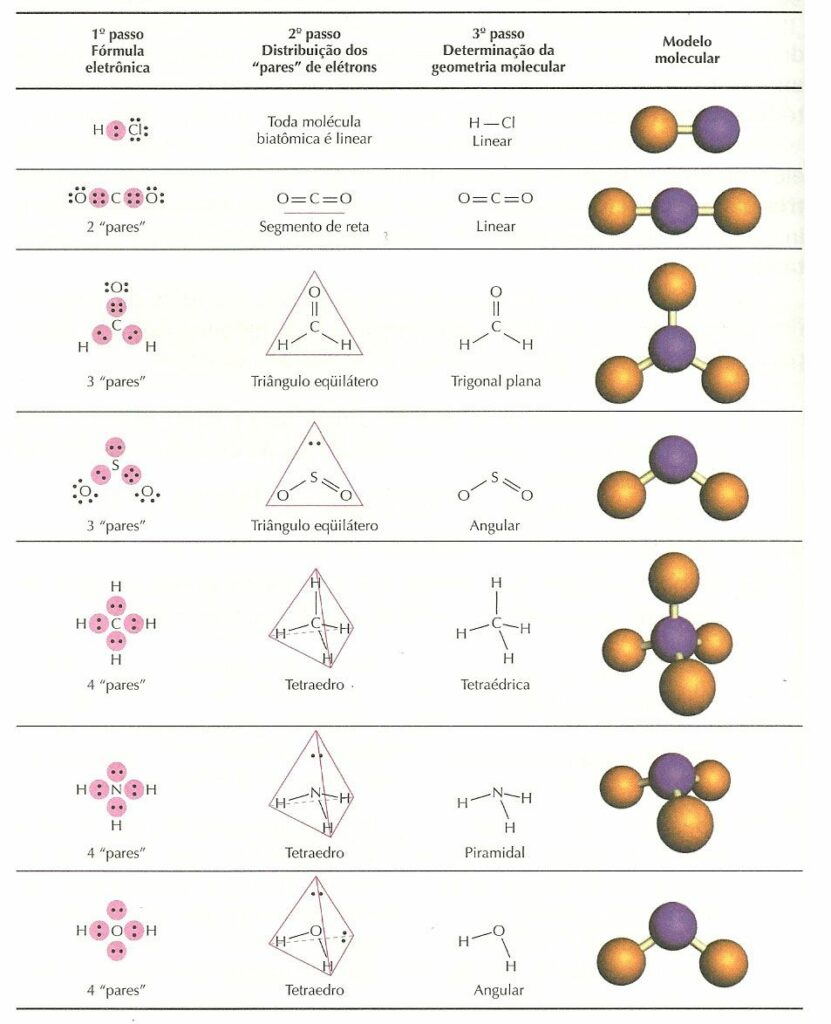
Para identificar e ter uma descrição completa da forma tridimensional de uma molécula, precisamos saber também aprender sobre o estado do ângulo de ligação também. As Estruturas de Pontos de Lewis Electron desempenham um papel crucial na determinação da geometria das moléculas porque nos ajuda a identificar os elétrons de valência. Para aprender como desenhar uma estrutura de elétrons de Lewis, clique no link acima.
Teoria da Repulsão de Pares de Elétrons de Camada de Valência
Agora que temos uma base na estrutura de elétrons de Lewis, podemos usá-la para localizar os elétrons de valência do átomo central. A teoria de repulsão de par de elétrons de camada de valência (VSEPR) afirma que os pares de elétrons se repelem, independentemente de estarem ou não em pares de ligação ou em pares isolados. Assim, os pares de elétrons se espalharão o mais longe possível um do outro para minimizar a repulsão. O VSEPR não se concentra apenas nos pares de elétrons, mas também se concentra nos grupos de elétrons como um todo. Um grupo de elétrons pode ser um par de elétrons, um par solitário, um único elétron desemparelhado, uma ligação dupla ou uma ligação tripla no átomo central. Usando a teoria VSEPR, os pares de ligação de elétrons e pares solitários no átomo central nos ajudarão a prever a forma de uma molécula.
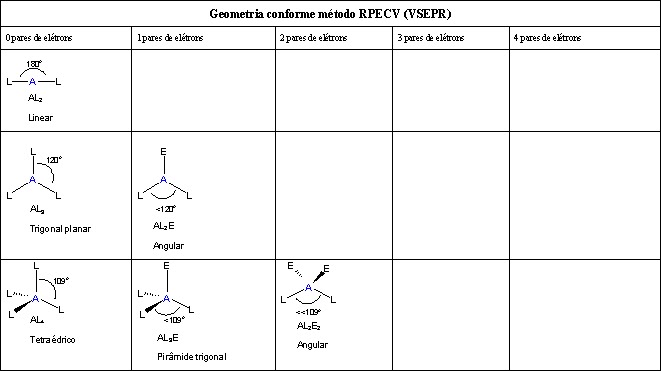
A forma de uma molécula é determinada pela localização dos núcleos e seus elétrons. Os elétrons e os núcleos se instalam em posições que minimizam a repulsão e maximizam a atração. Assim, a forma da molécula reflete seu estado de equilíbrio no qual ela tem a energia mais baixa possível no sistema. Embora a teoria VSEPR preveja a distribuição dos elétrons, temos que levar em consideração o real determinante da forma molecular. Nós separamos isso em duas categorias, a geometria do grupo de elétrons e a geometria molecular .
A geometria do grupo de elétrons é determinada pelo número de grupos de elétrons.
| Número de grupos de elétrons | Nome da geometria do grupo de elétrons |
|---|---|
| 2 | linear |
| 3 | trigonal-planar |
| 4 | tetraedro |
| 5 | trigonal bipiramidal |
| 6 | octaédrico |
A geometria molecular, por outro lado, depende não apenas do número de grupos de elétrons, mas também do número de pares isolados. Quando os grupos de elétrons são todos pares de ligações, eles são nomeados exatamente como a geometria do grupo de elétrons. Veja o gráfico abaixo para mais informações sobre como eles são nomeados, dependendo do número de pares solitários que a molécula possui.

Notação VSEPR
Como dito acima, a geometria molecular e a geometria do grupo de elétrons são as mesmas quando não há pares isolados. A notação VSEPR para essas moléculas é AX n . “A” representa o átomo central e n representa o número de ligações com o átomo central. Quando pares isolados estão presentes, a letra E x é adicionada. O x representa o número de pares solitários presentes na molécula. Por exemplo, uma molécula com dois pares de ligações e dois pares solitários teria essa notação: AX 2 E 2 .
Moléculas com mais de um átomo central
A teoria do VSEPR não se aplica apenas a um átomo central, mas se aplica a moléculas com mais de um átomo central. Levamos em conta a distribuição geométrica dos átomos terminais ao redor de cada átomo central. Para a descrição final, combinamos a descrição separada de cada átomo. Em outras palavras, pegamos moléculas de cadeia longa e a dividimos em pedaços. Cada peça irá formar uma forma particular. Siga o exemplo abaixo:
O butano é C 4 H 10 . CCCC é a fórmula estrutural simplificada onde os hidrogênios (não mostrados) estão implicados para ter ligações simples ao carbono.
Se quebrarmos cada carbono, os átomos centrais, em pedaços, podemos determinar a forma relativa de cada seção. Vamos começar com o lado mais à esquerda. Vemos que C tem três ligações simples a 2 hidrogênios e uma ligação simples a carbono. Isso significa que temos 4 grupos de elétrons. Ao verificar a geometria do gráfico de moléculas acima, temos uma forma tetraédrica. Agora, passamos para o próximo Carbono. Este carbono tem 2 ligações simples para 2 carbonos e 2 ligações simples para 2 hidrogênios. Novamente, temos 4 grupos de elétrons que resultam em um tetraedro. Continuando essa tendência, temos outro tetraedro com ligações simples ligadas a átomos de hidrogênio e carbono. Quanto ao carbono mais à direita, também temos um tetraedro onde o carbono se liga com um carbono e 3 hidrogênios.

Deixe-me recapitular. Nós demos uma olhada no butano fornecido pelo maravilhoso link da Wikipédia. Nós, então, quebramos a molécula em partes. Fizemos isso olhando um determinado átomo central. Neste caso, temos 4 átomos centrais, todos de carbono. Ao quebrar a molécula em 4 partes (cada parte olha para 1 dos 4 carbonos), determinamos quantos grupos de elétrons existem e descobrimos as formas.
Ainda não terminamos! Precisamos determinar se há pares solitários porque só olhamos para títulos. Lembre-se que grupos de elétrons incluem pares solitários! O butano não tem pares isolados. Por isso, temos 4 tetraédricos. Agora, o que vamos fazer com 4 tetraedros? Bem, queremos otimizar o ângulo de ligação de cada átomo central ligado um ao outro. Isso ocorre porque os elétrons compartilhados são mais propensos a se repelirem.
Ângulos de Ligação
Os ângulos de ligação também contribuem para a forma de uma molécula. Ângulos de ligação são os ângulos entre linhas adjacentes que representam títulos. O ângulo de ligação pode ajudar a diferenciar entre linear, trigonal planar, tetraheral, trigonal-bipiramidal e octaédrica. Os ângulos de ligação ideais são os ângulos que demonstram o ângulo máximo onde minimizaria a repulsão, verificando assim a teoria do VSEPR.
Essencialmente, os ângulos de adesão estão nos dizendo que os elétrons não gostam de estar próximos uns dos outros. Elétrons são negativos. Dois negativos não atraem. Vamos criar uma analogia. Geralmente, uma pessoa negativa é vista como ruim ou malvada e você não quer falar com uma pessoa negativa. Uma pessoa negativa é ruim o suficiente, mas se você tem dois juntos … isso é horrível. As duas pessoas negativas serão más em relação umas às outras e não vão gostar uma da outra. Então, eles estarão longe um do outro. Podemos aplicar essa ideia aos elétrons. Os elétrons são igualmente responsáveis e se repelem. A maneira mais distante que eles podem se afastar é através dos ângulos. Agora, vamos nos referir aos tetraedros. Por que é que 90 graus não funciona? Bem, se desenharmos um tetraédrico em um plano 2-D, então obteremos 90 graus. Contudo, Nós vivemos em um mundo 3D. Para visualizar isso, pense em filmes. Filmes em 3D aparecem para nós. Antes, vemos filmes que estão apenas na tela e isso é bom. O que é melhor? 3D ou 2D? Para ângulos de ligação, o 3D é melhor. Portanto, os tetraédricos têm um ângulo de ligação de 109,5 graus. Como os cientistas conseguiram esse número foi através de experimentos, mas não precisamos conhecer muitos detalhes, porque isso não é descrito no livro ou palestra.
Usando o exemplo acima, gostaríamos de acrescentar que H 2 O tem um ângulo de ligação de 109,5 ° e o CO 2 teria um ângulo de ligação de 180 ° .

Etapas usadas para encontrar a forma da molécula
Para resumir, existem quatro passos simples para aplicar a teoria do VSEPR.
- Desenhe a estrutura de Lewis.
- Conte o número de grupos de elétrons e identifique-os como pares de ligação de grupos de elétrons ou pares isolados de elétrons. Lembre-se que os grupos de elétrons incluem não apenas ligações, mas também pares solitários!
- Nomeie a geometria do grupo de elétrons. (Indique se é linear, trigonal-planar, tetraédrico, trigonal-bipiramidal ou octaédrico).
- Olhando para as posições de outros núcleos atômicos ao redor da central, determine a geometria molecular. (Veja quantos pares solitários existem.)
Momentos Dipolares
Uma molécula é polar quando os elétrons não são distribuídos igualmente e a molécula tem dois pólos. O final mais eletronegativo da molécula é o final negativo e o final menos eletronegativo é o final positivo. Um exemplo comum é o HCl. Usando o capital sigma + ou – como um símbolo para mostrar o fim positivo e o fim negativo, podemos desenhar o dipolo líquido. Então sigma + estaria no átomo de hidrogênio e sigma – estaria no átomo de cloro. Usando a seta cruzada mostrada abaixo, podemos mostrar que ela tem um dipolo líquido. O dipolo líquido é o mensurável, que é chamado de momento dipolar. O momento do dipolo é igual ao produto da carga parcial e da distância. A equação para o momento dipolar é a seguinte.μ = δ× d(1)(1)μ=δ×d
com
- µ = momento dipolar ( debye )
- δ = carga parcial (C)
- d = distância (m)
As unidades para dipolo são expressas em bybye que também é conhecido como Coulombs x meter (C xm)
Recapitulando, quando uma molécula é polar significa que o elétron não é distribuído uniformemente e há uma diferença na eletronegatividade dos átomos. Se uma molécula é polar, significa que ela tem um dipolo líquido que resulta em um momento dipolar.
Determinando a Polaridade
É polar? Existem três maneiras de determinar se uma molécula é polar ou não.
A. Se a molécula tem um dipolo líquido, então é polar.
B. Se a estrutura é simétrica, então é não-polar
C. Existem três regras para esta parte:
1. Quando não há pares solitários no átomo central, então a molécula é apolar
2. Se for linear ou quadrado planar, então é não-polar. (Esta regra é mais importante que a regra 1, por isso ela é sobreposta porque possui pares isolados.)
3. Se ela possui átomos de terminal diferentes, ela é polar. (Esta regra anula as regras 1 e 2 porque é mais importante.)


