
Aminas são qualquer membro de uma família de compostos orgânicos contendo nitrogênio que é derivado, em princípio ou na prática, de amônia (NH 3).
As aminas que ocorrem naturalmente incluem os alcaloides, que estão presentes em certas plantas; os neurotransmissores de catecolamina (isto é, dopamina, epinefrina e norepinefrina); e um mediador químico local, a histamina, que ocorre na maioria dos tecidos animais.

Anilina, etanolamina, e várias outras aminas são importantes produtos industriais utilizados no fabrico de borracha, corantes, produtos farmacêuticos , e sintéticas resinas e fibras e para uma série de outras aplicações. A maioria dos numerosos métodos para a preparação de aminas pode ser dividida em dois grupos: redução química (substituição de oxigênio por átomos de hidrogênio na molécula) de membros de várias outras classes de compostos nitrogenados orgânicos e reações de amônia ou aminas com compostos orgânicos.
As aminas são classificadas como primário, secundário ou terciário, dependendo se um, dois ou três dos átomos de hidrogênio da amônia foram substituídos por grupos orgânicos. Em notação química, essas três classes são representadas como RNH 2, R 2 NH e R 3 N, respectivamente. Uma quarta categoria consiste em compostos de amônio quaternário, que são obtidos por substituição de todos os quatro átomos de hidrogênio do íon amônio, NH 4 +; um ânion é necessariamente associado (R 4 N + X – ). Aminas também são classificadas como alifático, tendo apenas grupos alifáticos ligados, ou aromático, tendo um ou mais grupos arilo ligados. Eles podem ser de cadeia aberta, em que o nitrogênio não faz parte de um anel, ou cíclico, no qual é um membro de um anel (geralmente alifático).
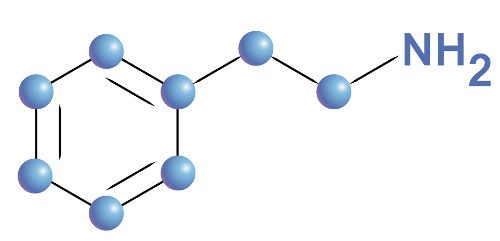
O sistema mais antigo e mais amplamente usado para nomear aminas é identificar cada grupo que está ligado ao átomo de nitrogênio e, em seguida, adicionar a amina final , como emmetilamina, CH 3 NH 2 ; N-etil-N-propilamina (ou etil (propil) amina), CH 3 CH 2NHCH 2 CH 2 CH 3 ; etributilamina, (CH 3 CH 2 CH 2 CH 2 ) 3 N. Dois ou mais grupos citados estão por ordem alfabética; para esclarecer quais grupos estão ligados ao nitrogênio e não uns aos outros, Ns ou parênteses internos são usados. Algumas aminas aromáticas e a maioria das aminas cíclicas têm nomes triviais (não-sistemáticos) (por exemplo, anilina, C 6H 5 NH 2 ), que pode ser usado como um pai (unidade estrutural básica) em que para especificar quaisquer outros grupos ligados, tal como em N, N-dimetilanilina.
Um método alternativo substitui o terminal -e de um nome de hidrocarboneto pelo sufixo -amina para indicar o grupo funcional ―NH 2. Com aminas secundárias e terciárias, o maior grupo é escolhido como o pai, e os outros grupos são nomeados como substituintes. Os nomes neste sistema para os exemplos anteriores são metanamina, N-etilpropanamina e N, N-dibutilbutanamina. A dimetilanilina é denominada N, N-dimetilbenzenamina. Quando outro grupo funcional do composto tem uma prioridade maior que o grupo amino (-NH 2 , -NHR ou NR 2 ), este último é denominado como um substituinte, como no ácido aminoacético, NH 2-CH 2 COOH, e cloreto de 2- (dimetilamino) etanol, (CH 3 ) 2 N-CH 2 CH 2OH. (As diretrizes simples dadas aqui podem não ser adequadas para estruturas mais complexas).

Quais são as Propriedades das Aminas?
Os odores distintos que são duvidosos a pútridos caracterizam as aminas de baixo peso molecular. São gases à temperatura ambiente ou são facilmente líquidos vaporizados. As aminas alifáticas são menos densas que a água, tendo densidades na faixa de 0,63 a 0,74 grama por cm cúbico; aminas aromáticas são tipicamente ligeiramente mais pesadas que a água (por exemplo, a densidade da anilina é de 1,02 gramas por cm cúbico). Com tamanho crescente, eles se tornam menos voláteis; o odor diminui e, eventualmente, torna-se imperceptível, embora algumas diaminas tenham odores desagradáveis. Por exemplo, H 2N (CH 2 ) 4 NH 2, chamado putrescina e H 2 N (CH 2 ) 5 NH 2, chamado cadaverina, são compostos de mau cheiro encontrados em carne em decomposição.
As aminas são incolores; as aminas alifáticas são transparentes à luz ultravioleta, mas as aminas aromáticas apresentam uma forte absorção de certos comprimentos de onda. Aminas com menos de seis carbonos misturam-se com a água em todas as proporções. As aminas alifáticas são bases mais fortes que a amônia, e as aromáticas são substancialmente mais fracas. A basicidade é medida em termos do valor de pK b , que é igual a −logK b , onde K bé a constante de equilíbrio para a reação B + H 3 O + ⇌ BH + + H 2 O (B é a amina). Assim, um pK maiorO valor b indica maior força como base. Para comparação, o pK b de amónia é 4,75. Os hidróxidos de amônio quaternário são bases muito fortes, mas os cloretos não são básicos.

A maioria das aminas alifáticas não é altamente tóxica, e muitos são componentes inofensivos e naturais de alimentos e produtos farmacêuticos. Em altas concentrações, no entanto, as aminas menores são altamente irritantes para a pele e especialmente para as membranas mucosas dos olhos, nariz, garganta e pulmões, às quais podem causar danos agudos após exposição prolongada. Aminas maiores (12 ou mais átomos de carbono) são geralmente menos irritantes. Aminas aromáticas também são irritantes e podem ser absorvidas através da pele. Eles podem ser venenos perigosos. A anilina, por exemplo, destrói a hemoglobina do sangue e a exposição prolongada tem sido associada ao câncer. As aminas podem ser corrosivas para alguns metais e plásticos; eles devem, portanto, ser armazenados em recipientes de vidro ou aço.
Uma molécula de amina tem a forma de uma pirâmide triangular um tanto achatada, com o átomo de nitrogênio no ápice. Um par de elétrons não compartilhado está localizado acima do átomo de nitrogênio. Em íons de amônio quaternário esta região é ocupada por um substituinte, formando um tetraedro quase regular com o átomo de nitrogênio em seu centro.

Formas destras e destras (configurações de imagem espelhada, conhecidas como isómeros ópticos ou enantiômeros) são possíveis quando todos os substituintes no átomo de nitrogênio central são diferentes (isto é, o nitrogênio é quiral). Com aminas, há inversão extremamente rápida em que as duas configurações são interconvertidas. O processo é como um guarda-chuva girando de dentro para fora ao vento; os substituintes se movem em uma direção (“para cima”) e o átomo de nitrogênio na outra (“para baixo”). Os íons de amônio quaternário não sofrem esse equilíbrio com poucas condições em que se decompõem; seus isômeros ópticos são indefinidamente estáveis e isolados, e os efeitos fisiológicos dos dois enantiômeros podem ser profundamente diferentes.
Fontes e Ocorrência de Aminas
Aminas alifáticas ocorrem na natureza, principalmente como produtos da putrefação de material proteico, mas também estão presentes no tecido vivo (por exemplo, histamina, uma amina alifática cíclica). As metilaminas ocorrem em pequenas quantidades em algumas plantas. Muitas aminas polifuncionais (isto é, aquelas que têm outros grupos funcionais na molécula) ocorrem como alcaloides nas plantas – por exemplo, mescalina, 2- (3,4,5-trimetoxifenil) etilamina; as aminas clicas nicotina, atropina, morfina e coca ; e o sal quaternário colina, cloreto de N- (2-hidroxietil) trimetilamónio, que está presente nas sinapses nervosas e nas células vegetais e animais.

Grandes quantidades de aminas alifáticas são feitas sinteticamente. O método industrial mais utilizado é a reação de álcoois com amônia em alta temperatura, catalisada por metais ou catalisadores de óxido de metal (por exemplo, níquel ou cobre). Misturas de aminas primárias, secundárias e terciárias são assim produzidas. Algumas aminas – como a hexametilenodiamina, usada no fabrico de nylon -6,6, é feita por adição catalítica de hidrogênio a nitrilos, R≡CN.
A anilina e algumas outras aminas aromáticas foram obtidas de alcatrão de carvão, mas hoje são sintetizadas a partir de benzeno, C 6 H 6 , ou outros hidrocarbonetos. O benzeno é primeiro convertido em nitrobenzeno (C 6 H 5 NO 2 ) ou clorobenzeno (C 6 H 5 Cl). O primeiro é reduzido a anilina por tratamento com hidrogênio sobre um catalisador ou por meio de outros reagentes, como ferro ou sulfeto de hidrogênio (Fe e H 2 S, respectivamente). Anilina é feita de clorobenzeno por tratamento com amônia a uma temperatura elevada na presença de compostos de cobre.

Numa escala menor, tal como na indústria farmacêutica ou no laboratório de pesquisa, os métodos anteriores podem não ser adequados devido aos custos de engenharia e à formação de uma mistura de produtos. Para a síntese de produtos únicos e operações de pequena escala, outras reações estão disponíveis. A reação de halogenetos de alquilo, R X X, em que X é um halogéneo , ou reagentes análogos com amoníaco (ou aminas) são úteis em certos compostos. Uma mistura de aminas mono-, di- e trialquiladas e, às vezes, também o sal de amônio quaternário, geralmente resulta:
RCH 2 X + NH 3 →
RCH 2 NH 2 , (RCH 2 ) 2 NH, (RCH 2 ) 3 N, (RCH 2 ) 4 N + X –
Nem todos os halogenetos de alquilo são reagentes eficazes; a reação é lenta com grupos alquílicos secundários e falha com os terciários. Sua utilidade é amplamente confinada a halogenetos de alquila primários (aqueles que possuem dois átomos de hidrogênio no local de reação). Para evitar o problema da alquilação múltipla, foram concebidos métodos para a substituição de “bloqueio”, de modo que apenas um grupo alquilo é introduzido. A síntese de Gabriel é um desses métodos; utiliza ftalimida, C 6 H 4 (CO) 2 NH, cujo um átomo de hidrogênio acídico foi removido após a adição de uma base, tal como KOH, para formar um sal.
Embora a ftalimida em si não seja reativa, seu ânion reagirá com haletos de alquila, mas apenas uma vez. A hidrólise da alquilftalimida resultante liberta a amina primária.
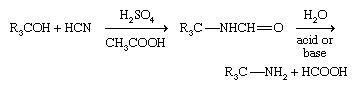
As aminas primárias que possuem um grupo alquílico terciário (R 3 CNH 2 ) são difíceis de preparar com a maioria dos métodos, mas são feitas industrialmente pela Reação de Ritter. Neste método, um álcool terciário reage com cianeto de hidrogênio (HCN) na presença de um ácido forte concentrado; uma formamida, RNH-CHO, é formada primeiro, que então sofre hidrólise.
A reação de amônia com alcenos a altas temperaturas e pressão, catalisada por zeólitos, também é empregada industrialmente.
Redução de compostos nitro, RNO 2 , por hidrogênio ou outros agentes redutores produzem aminas primárias de forma limpa (ou seja, sem uma mistura de produtos), mas o método é usado principalmente para aminas aromáticas devido à disponibilidade limitada de nitro compostos alifáticos. A redução de nitrilos e oximas (R 2 C = NOH) também produz aminas primárias. Iminas, R 2 C = NR ‘, pode ser usado para preparar aminas secundárias, geralmente em um processo em que a imina é formada a partir de uma amina primária e um aldeído ou cetona e, em seguida, reduzido por hidrogênio e um catalisador de níquel. Amidas, RCONR ′ 2 , podem ser reduzidas a aminas por hidreto de alumínio e lítio (LiAlH 4), que substitui o oxigênio por dois hidrogênios. Se não houver um substituinte no nitrogênio (isto é, R = H), resulta uma amina primária. Quando um ou ambos os grupos R ‘não são hidrogênio, são produzidas aminas secundárias ou terciárias, respectivamente.
Entre as reações de rearranjo, destaca-se a Rearranjo de Hofmann, em que uma amida tratada com cloro ou bromo e uma base aquosa (base).
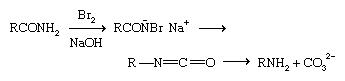
Uma série de etapas ocorre rapidamente. Em uma etapa intermediária, um grupo R se move do carbono carbonílico para o nitrogênio, deslocando o íon halogênio; a etapa final, a perda de um grupo CO 3 2- , leva a uma amina primária de um átomo de carbono a menos (isto é, RCONH 2 se torna RNH 2 ). o Rearranjo de Beckmann, pelo qual um cetoxima, R 2 C = NOH, é rearranjado para uma amida, RCONHR, pode ser usado para preparar aminas primárias quando seguido por hidrólise.
As aminas terciárias são tipicamente feitas por alquilação de aminas secundárias por halogenetos de alquilo:
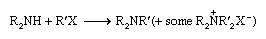
Alternativas são redução de amidas dissubstituídas ou redução de uma mistura de uma amina secundária e um aldeído pelo ácido fórmico (conhecido como a reação de Leuckart):
R 2 NH + R ‘ 2 C = O + HCOOH → R 2 N-CHR ‘ 2 + CO 2
Reações das Aminas
Adição
Aminas formam caracteristicamente sais com ácidos; um íon de hidrogênio, H + , adiciona nitrogênio. Com os fortes ácidos minerais (por exemplo, H 2 SO 4 , HNO 3 e HCl), a reação é vigorosa. A formação de sal é instantaneamente invertida por bases fortes como o NaOH. Neutros electrófilos (compostos atraídos para as regiões de carga negativa) também reagem com aminas; halogenetos de alquilo (R′X) e agentes alquilantes análogos são exemplos importantes de reagentes electrofílicos. Um sal é formado por adição; R 3 N torna-se R 3 NR ′ + X – .
RNH 2 + R’X → RR’N + H 2 X – → RNH 2 RR’NH + RN + H 3 X –
Embora as aminas terciárias não reajam com aldeídos e cetonas e as aminas secundárias reajam apenas reversivelmente, as aminas primárias reagem prontamente para formar iminas (também chamados azometinas ou bases de Schiff), R 2 C = NR ‘.
Substituição
A acilação é uma das reações mais importantes das aminas primárias e secundárias; um átomo de hidrogênio é substituído por um grupo acilo (um grupo derivado de um ácido, tal como RCOOH ou RSO 3 H, pela remoção de -OH, tal como RC (= O) -, RS (O) 2 -, e assim por diante ). Os reagentes podem ser cloretos de ido (RCOC1, RSO 2 C1), anidridos ((RCO) 2 O), ou mesmo ésteres (RCOOR ‘); os produtos são amidas dos ácidos correspondentes.
A reação com o fosgio, COC1 2 (o cloreto de ido de ido carbico, H 2 CO 3 ), tem uma grande importância industrial. Pode resultar em acilação simples para formar ureias(amidas de ácido carbônico), RNHCONHR, mas geralmente é realizada sob condições que favorecem a conversão de aminas primárias em isocianatos : RNH 2 + COCl 2 → RN = C = O + 2HCl). Os isocianatos são eles próprios agentes de acilação, de um tipo que também inclui isotiocianatos (RN = C = S), cetonas (R 2 = C = O), e dióxido de carbono (O = C = O). Eles reagem mais ou menos prontamente com aminas primárias e mais secundárias para formar, respectivamente, ureias, tioureias (RNHCSNHR), amidas e sais de ácido carbâmico (RNHCO 2 – RNH 3 + ).
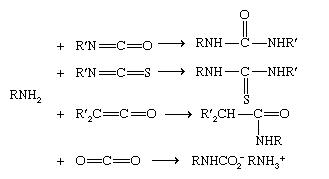
Reação com o ácido nitroso (HNO 2 ), que funciona como um agente de acilação que é uma fonte do grupo nitrosilo (NONO), converte aminas primárias alifáticas em nitrogênio e misturas de alcenos e álcoois correspondentes ao grupo alquila em um processo complexo.
R 2 CH-CR 2 -NH 2 + HNO 2 → R 2 CH-CR 2 NHNO →
N 2 + R 2 C = CR 2 ou R 2 CH CR CR 2 OH
Esta reação foi usada para a determinação analítica de grupos amino primários em um procedimento conhecido como Método de Van Slyke. Com aminas primárias aromáticas, o nitrogênio não é perdido se a mistura de reação é mantida fria (geralmente 0 ° C [32 ° F]), e um sal de diazônio, ArN 2 + X – , onde Ar é um grupo arila, é formado:
ArNH 2 + HNO 2 + HX → ArN 2 + X –
Estes compostos altamente reativos são de grande importância na síntese orgânica e na indústria de corantes.
O ácido nitroso converte aminas secundárias (alifáticas ou aromáticas) em compostos N-nitrosos (nitrosaminas ): R 2 NH + HNO 2 → R 2 N-NO. Algumas nitrosaminas são potentes substâncias indutoras de câncer, e sua possível formação é uma consideração séria quando nitritos , que são sais de ácido nitroso, estão presentes em alimentos ou preparações farmacêuticas. Aminas terciárias dão origem a nitrosaminas mais lentamente; um grupo alquilo é eliminado como um aldeído ou cetona, juntamente com o óxido nitroso, N 2 O.
A halogenação, em que um ou mais omos de hidrogênio de uma amina substitua por um tomo de halogênio, ocorre com cloro, bromo e iodo , bem como com alguns outros reagentes, nomeadamente o cido hipocloroso (HClO). Com aminas primárias, a reação prossegue em duas etapas, produzindo N-cloro- e N, N-dicloro-aminas, RNHCl e RNCl 2 , respectivamente. Com aminas terciárias, um grupo alquilo pode ser deslocado por um halogêneo.
Oxidação
As aminas podem queimar no ar, produzindo água, dióxido de carbono e nitrogênio ou seus óxidos. A oxidação mais leve, usando reagentes como NaOCl, pode remover quatro átomos de hidrogênio de aminas primárias do tipo RCH 2 NH 2 para formar nitrilos (R ≡ C≡N) e a oxidação com reagentes como MnO 2 pode remover dois átomos de hidrogénio de aminas secundárias (R 2 CH NH NHR ′) para formar iminas (R 2 C = NR ‘). Aminas terciárias podem ser oxidadas paraenaminas (R 2 C = CHNR 2 ) por uma variedade de reagentes.
R 2 CH CH CH 2 NR ′ 2 + Hg (OAc) 2 → R 2 C = CH N NR ′ 2
Peróxido de hidrogênio (H 2 O 2 ) e peroxi ácidos geralmente adicionam um átomo de oxigênio ao nitrogênio das aminas. Com aminas primárias, esta etapa é normalmente seguida por mais oxidação, levando a compostos nitrosos, RNO ou compostos nitro, RNO 2 . Aminas secundárias são convertidas em hidroxilaminas, R 2 NOH, e aminas terciárias a amina óxidos, R 3 NO.
Eliminação
A principal reação dos compostos de amônia quaternária é a degradação de Hofmann que ocorre quando os hidridos s fortemente aquecidos, gerando uma amina terciia; o grupo alquilo menos substituído é perdido como um alceno.
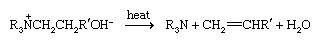
Uso de Aminas
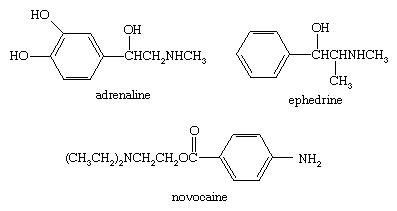
Exemplos de usos diretos de aminas e seus sais são como inibidores de corrosão em caldeiras e em óleos lubrificantes (morfolina), como antioxidantes para asfalto de borracha e cobertura (diarilaminas), como estabilizadores para explosivos nitratos de celulose (difenilamina), como protetores contra danos de radiação gama (diarilaminas), como desenvolvedores em fotografia (diaminas aromáticas), como agentes de flotação na mineração, como agentes anticlerificantes e impermeabilizantes para tecidos, como amaciantes de tecidos, em revestimentos de papel, e para solubilização de herbicidas. Algumas aminas polifuncionais são fármacos valiosos, como a efedrina eepinefrina (adrenalina) e anestésicos, como a novocaína.
Muitos produtos importantes requerem aminas como parte de suas sínteses. A metilamina é utilizada na produção da meperidina analgésica (nome comercial Demerol) e do revelador fotográfico Metol (marca comercial), e a dimetilamina é usada na síntese da difenidramina anti-histamínica (nome comercial Benadryl), do solvente dimetilformamida (DMF) e propelente de foguete 1,1-dimetil-hidrazina. A síntese do repelente de insectos N, N-dietil-m-toluamida (DEET) incorpora dietilamina, enquanto a da fibra sintética Kevlar requer aminas aromáticas. Poliuretanos são formados a partir de metilenodianilina através do seu diisocianato. Outros produtos que utilizam aminas em sua síntese incluem spandex, cafeína , explosivos (por exemplo, 2,3,4,6-tetranitro-N-methylaniline [TNA] e 2,4,6-N-tetranitroaniline [Tetryl]), pesticidas, fungicidas, herbicidas, azo corantes e alguns corantes de trifenilmetano.


