
Álcool é qualquer classe de compostos orgânicos caracterizados por um ou mais grupos hidroxilo (OHOH) ligados a um átomo de carbono de um grupo alquilo ( cadeia de hidrocarbonetos). Os álcoois podem ser considerados como derivados orgânicos de água (H 2 O) em que um dos átomos de hidrogênio foi substituído por um grupo alquila, tipicamente representado por R em estruturas orgânicas. Por exemplo, em etanol (ou álcool etílico), o grupo alquilo é o grupo etilo, -CH 2 CH 3 .
Os álcoois estão entre os compostos orgânicos mais comuns. Eles são usados como adoçantes e na produção de perfumes, são valiosos intermediários na síntese de outros compostos e estão entre os produtos químicos orgânicos mais abundantes na indústria. Talvez os dois álcoois mais conhecidos sejam etanol e metanol (ou álcool metílico).

O etanol é usado em produtos de higiene, produtos farmacêuticos e combustíveis, e é usado para esterilizar instrumentos hospitalares. É, além disso, o álcool em bebidas alcoólicas. O éter anestésico também é feito de etanol. O metanol é utilizado como solvente, como matéria-prima para a fabricação de formaldeído e resinas especiais, em combustíveis especiais,anticongelante e para limpeza de metais.
Os álcoois podem ser classificados como primários, secundários ou terciários, de acordo com o qual o carbono do grupo alquilo está ligado ao grupo hidroxilo. A maioria dos álcoois são líquidos incolores ou sólidos à temperatura ambiente. Álcoois de baixo peso molecular são altamente solúveis em água; com o aumento do peso molecular, eles se tornam menos solúveis em água, e seus pontos de ebulição, pressões de vapor, densidades e viscosidades aumentam.

Estrutura e Classificação do Álcool
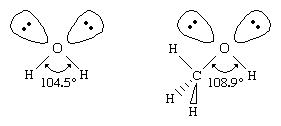
Semelhante à da água, um álcool pode ser imaginado como tendo um s p 3 hibridado tetraédrico oxigênio átomo com pares não ligantes de eléctrons que ocupam dois dos quatro s p 3 orbitais híbridos. Os grupos alquila são geralmente mais volumosos do que os átomos de hidrogênio, no entanto, de modo que o R – O – H. O ângulo de ligação em álcoois é geralmente maior que o ângulo de ligação de 104,5 ° H – O – H em água. Por exemplo, o ângulo de ligação de 108,9 ° em metanol mostra o efeito do grupo metila, que é maior que o átomo de hidrogênio da água.
Uma maneira de classificar álcoois é baseada em qual átomo de carbono está ligado ao grupo hidroxila. Se este carbono é primário (1 °, ligado a apenas um outro átomo de carbono), o composto é um álcool primário. O álcool secundário possui o grupo hidroxila em um átomo de carbono secundário (2 °), que está ligado a dois outros átomos de carbono. Da mesma forma,o álcool terciário tem o grupo hidroxila em um átomo de carbono terciário (3 °), que é ligado a três outros carbonos. Álcoois são referidos comoalílico ou benzílico se o grupo hidroxila estiver ligado a um átomo de carbono alílico (adjacente a uma dupla ligação C = C) ou a um átomo de carbono benzílico (próximo a um anel benzênico), respectivamente.

Nomenclatura dos Álcoois
Tal como acontece com outros tipos de compostos orgânicos, os álcoois são nomeados pelos sistemas formal e comum. O sistema mais geralmente aplicável é o adotado em uma reunião da União Internacional de Química Pura e Aplicada (IUPAC) em Paris em 1957. Usando o sistema IUPAC, o nome para um álcool usa o sufixo -ol com o nome do alcano pai, junto com um número para dar a localização do grupo hidroxila. As regras são resumidas em um procedimento de três etapas:
- Nomeie a cadeia de carbono mais longa que contém o átomo de carbono que contém o grupo ―OH. Solte o final -e do nome do alcano e adicione o sufixo -ol.
- Numere a cadeia de carbono mais longa começando na extremidade mais próxima do grupo ―OH, e use o número apropriado, se necessário, para indicar a posição do grupo ―OH.
- Nomear os substituintes e dar seus números como para um alcano ou alceno.

O primeiro exemplo abaixo tem uma cadeia mais longa de seis átomos de carbono, então o nome da raiz é hexanol. O grupo OH está no terceiro átomo de carbono, que é indicado pelo nome 3-hexanol. Há um grupo metila no carbono 3 e um átomo de cloro no carbono 2. O nome IUPAC completo é 2-cloro-3-metil-3-hexanol. O prefixo cyclo- é usado para álcoois com grupos alquílicos cíclicos. Presume-se que o grupo hidroxilo esteja no carbono 1, e o anel é numerado na direção para dar os números mais baixos possíveis aos outros substituintes, como, por exemplo, 2,2-dimetilciclopentanol.
O nome comum de um álcool combina o nome do grupo alquílico com a palavra álcool. Se o grupo alquil é complexo, o nome comum torna-se desajeitado e o nome IUPAC deve ser usado. Nomes comuns freqüentemente incorporam termos obsoletos na nomenclatura do grupo alquila; por exemplo, o amilo é freqüentemente usado em vez de pentila para uma cadeia de cinco carbonos.
Quais são as Propriedades Físicas dos Álcoois?
A maioria dos álcoois comuns é líquida e incolor à temperatura ambiente. Álcool metílico, álcool etílico e o álcool isopropílico são um líquido de fluxo livre com odores frutados. Os álcoois superiores – aqueles contendo 4 a 10 átomos de carbono – são um tanto viscosos, ou oleosos, e têm odores frutados mais pesados. Alguns dos álcoois altamente ramificados e muitos álcoois contendo mais de 12 átomos de carbono são sólidos à temperatura ambiente.
| Nome IUPAC | nome comum | Fórmula | pf (° C) |
|---|---|---|---|
| Nome IUPAC | pb (° C) | densidade (gramas por mililitro) | Solubilidade em Água |
| metanol | álcool metílico | CH 3 OH | −97 |
| etanol | Álcool etílico | CH 3 CH 2 OH | −114 |
| 1-propanol | álcool n-propílico | CH 3 CH 2 CH 2 OH | −126 |
| 2-propanol | álcool isopropílico | (CH 3 ) 2 CHOH | −89 |
| 1-butanol | álcool n-butílico | CH 3 (CH 2 ) 3 OH | −90 |
| 2-butanol | álcool sec-butílico | (CH 3 ) CH (OH) CH 2 CH 3 | −114 |
| 2-metil-1-propanol | álcool isobutílico | (CH 3 ) 2 CHCH 2 OH | −108 |
| 2-metil-2-propanol | Álcool t-butílico | (CH 3 ) 3 COH | 25 |
| 1 pentanol | álcool n-pentílico | CH 3 (CH 2 ) 4 OH | −79 |
| 3-metil-1-butanol | álcool isopentílico | (CH 3 ) 2 CHCH 2 CH 2 OH | −117 |
| 2,2-dimetil-1-propanol | álcool neopentílico | (CH 3 ) 3 CCH 2 OH | 52 |
| ciclopentanol | álcool ciclopentílico | ciclo-C 5 H 9 OH | −19 |
| 1-hexanol | n-hexanol | CH 3 (CH 2 ) 5 OH | −52 |
| ciclohexanol | álcool ciclohexílico | ciclo-C 6 H 11 OH | 25 |
| 1-heptanol | álcool n-heptilico | CH 3 (CH 2 ) 6 OH | −34 |
| 1 octanol | álcool n-octilico | CH 3 (CH 2 ) 7 OH | −16 |
| 1-nonanol | álcool n-nonílico | CH 3 (CH 2 ) 8 OH | −6 |
| 1-decanol | álcool n-decílico | CH 3 (CH 2 ) 9 OH | 6 |
| 2-propen-1-ol | álcool alílico | H 2 C = CH − CH 2 OH | −129 |
| fenilmetanol | Álcool benzílico | Ph − CH 2 OH * | −15 |
| difenilmetanol | difenilcarbinol | Ph 2 CHOH * | 69 |
| trifenilmetanol | trifenilcarbinol | Ph 3 COH * | 162 |
| metanol | 65 | 0,79 | miscível |
| etanol | 78 | 0,79 | miscível |
| 1-propanol | 97 | 0,80 | miscível |
| 2-propanol | 82 | 0,79 | miscível |
| 1-butanol | 118 | 0,81 | 9,1% |
| 2-butanol | 100 | 0,81 | 7,7% |
| 2-metil-1-propanol | 108 | 0,80 | 10,0% |
| 2-metil-2-propanol | 83 | 0,79 | miscível |
| 1 pentanol | 138 | 0,82 | 2,7% |
| 3-metil-1-butanol | 132 | 0,81 | 2,0% |
| 2,2-dimetil-1-propanol | 113 | 0,81 | 3,5% |
| ciclopentanol | 141 | 0,95 | |
| 1-hexanol | 156 | 0,82 | 0,6% |
| ciclohexanol | 162 | 0,96 | 3,6% |
| 1-heptanol | 176 | 0,82 | 0,1% |
| 1 octanol | 194 | 0,83 | |
| 1-nonanol | 214 | 0,83 | |
| 1-decanol | 233 | 0,83 | |
| 2-propen-1-ol | 97 | 0,86 | |
| fenilmetanol | 205 | 1,05 | |
| difenilmetanol | 298 | ||
| trifenilmetanol | 380 | 1,20 | |
| * Ph representa o grupo fenilo, C 6 H 5 -. |

Os pontos de ebulição dos álcoois são muito superiores aos dos alcanos com pesos moleculares semelhantes. Por exemplo, o etanol, com um peso molecular (MW) de 46, tem um ponto de ebulição de 78 ° C (173 ° F), enquanto o propano (MW 44) tem um ponto de ebulição de -42 ° C (-44 ° F) . Uma diferença tão grande nos pontos de ebulição indica que as moléculas de etanol são atraídas umas às outras muito mais fortemente do que as moléculas de propano. A maior parte desta diferença resulta da capacidade do etanol e de outros álcoois para formar pontes de hidrogênio intermoleculares.
A água e os álcoois têm propriedades similares porque as moléculas de água contêm grupos hidroxila que podem formar ligações de hidrogênio com outras moléculas de água e com moléculas de álcool, e também moléculas de álcool podem formar ligações de hidrogênio com outras moléculas de álcool, bem como com a água. Como os álcoois formam ligações de hidrogênio com a água, eles tendem a ser relativamente solúveis em água. O grupo hidroxila é referido como grupo hidrofílico (“amante da água”), porque forma ligações de hidrogênio com água e aumenta a solubilidade de um álcool na água. Metanol, etanol, álcool n- propílico, álcool isopropílico e álcool t – butílico são todos miscíveis com água. Álcoois com pesos moleculares mais altos tendem a ser menos solúveis em água, porque a parte de hidrocarboneto da molécula, que é hidrofóbico (“odiador de água”), é maior com maior peso molecular. Por serem altamente polares, os álcoois são melhores solventes que os hidrocarbonetos para compostos iônicos e outras substâncias polares.


