A teoria atômica percorreu um longo caminho nos últimos milhares de anos. Começando no século 5 aC com a teoria de Demócrito de “corpúsculos” indivisíveis que interagem uns com os outros mecanicamente, passando para o modelo atômico de Dalton no século 18, e então amadurecendo no século 20 com a descoberta de partículas subatômicas e teoria quântica, a jornada da descoberta foi longa e sinuosa.
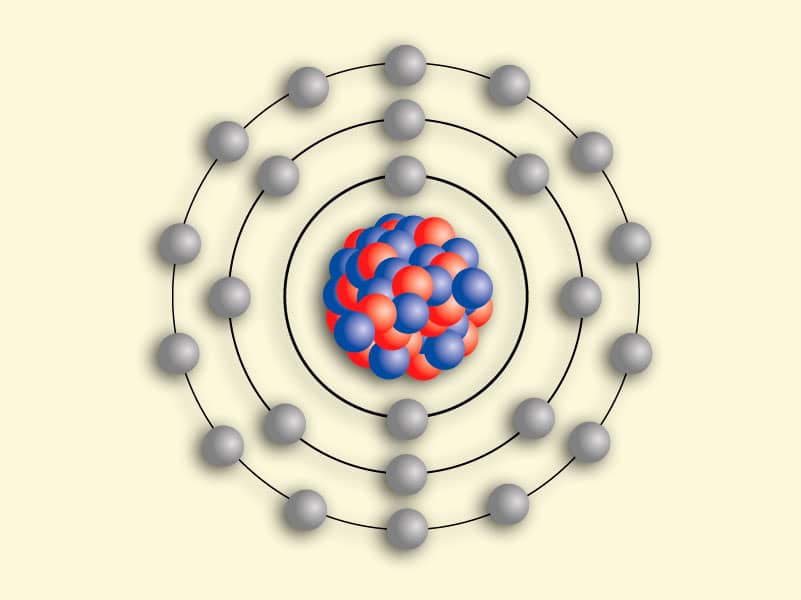
Indiscutivelmente, um dos mais importantes marcos ao longo do caminho tem sido o modelo atômico de Bohr, que às vezes é chamado de modelo atômico de Rutherford-Bohr. Proposto pelo físico dinamarquês Niels Bohr em 1913, este modelo descreve o átomo como um pequeno núcleo carregado positivamente cercado por elétrons que viajam em órbitas circulares (definidas por seus níveis de energia) ao redor do centro.
Os primeiros exemplos conhecidos de teoria atômica vêm da Grécia e da Índia antigas, onde filósofos como Demócrito postulavam que toda matéria era composta de unidades minúsculas, indivisíveis e indestrutíveis. O termo “átomo” foi cunhado na Grécia antiga e deu origem à escola de pensamento conhecida como “atomismo”. No entanto, essa teoria era mais um conceito filosófico do que científico.
Não foi até o século 19 que a teoria dos átomos se tornou articulada como uma questão científica, com os primeiros experimentos baseados em evidências sendo conduzidos. Por exemplo, no início de 1800, o cientista inglês John Dalton usou o conceito do átomo para explicar por que elementos químicos reagiram de certas maneiras observáveis e previsíveis. Através de uma série de experimentos envolvendo gases, Dalton desenvolveu o que é conhecido como Teoria Atômica de Dalton.
Essa teoria expandiu-se sobre as leis da conversação de proporções de massa e definidas e desceu para cinco premissas: elementos, em seu estado mais puro, consistem em partículas chamadas átomos; os átomos de um elemento específico são todos iguais, até o último átomo; átomos de diferentes elementos podem ser separados por seus pesos atômicos; átomos de elementos se unem para formar compostos químicos; átomos não podem ser criados ou destruídos em reação química, apenas o agrupamento muda.

Descoberta do Elétron
No final do século 19, os cientistas também começaram a teorizar que o átomo era composto de mais de uma unidade fundamental. No entanto, a maioria dos cientistas aventou que esta unidade seria do tamanho do menor átomo conhecido – o hidrogênio. No final do século 19, isso mudaria drasticamente, graças a pesquisas conduzidas por cientistas como Sir Joseph John Thomson.
Através de uma série de experimentos usando tubos de raios catódicos (conhecidos como Tubo de Crookes), Thomson observou que os raios catódicos poderiam ser desviados por campos elétricos e magnéticos. Ele concluiu que, em vez de serem compostos de luz, eles eram compostos de partículas carregadas negativamente, que eram milionésimas vezes menores e 1800 vezes mais leves que o hidrogênio.

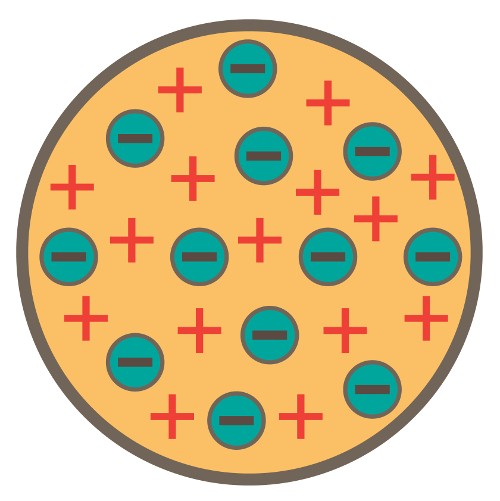
Isso efetivamente refutou a noção de que o átomo de hidrogênio era a menor unidade de matéria, e Thompson foi além, sugerindo que os átomos eram divisíveis. Para explicar a carga geral do átomo, que consistia em cargas positivas e negativas, Thompson propôs um modelo pelo qual os “corpúsculos” carregados negativamente eram distribuídos em um mar uniforme de carga positiva – conhecido como o Modelo “Pudim de Passas”.
Esses corpúsculos seriam posteriormente denominados “elétrons”, baseados na partícula teórica prevista pelo físico anglo-irlandês George Johnstone Stoney em 1874. E a partir disso nasceu o Modelo “Pudim de Passas”, assim chamado porque se assemelhava ao deserto inglês que consiste em Bolo de ameixa e passas. O conceito foi apresentado ao mundo na edição de março de 1904 da revista Philosophical Magazine do Reino Unido, com grande sucesso.
O Modelo de Rutherford
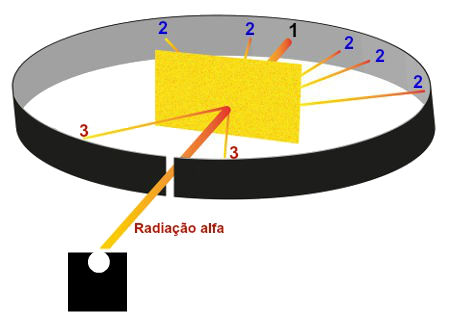
Experimentos subsequentes revelaram vários problemas científicos com o modelo Plum Pudding. Para começar, havia o problema de demonstrar que o átomo possuía uma carga de fundo positiva uniforme, que veio a ser conhecida como o “Problema de Thomson”. Cinco anos depois, o modelo seria desmentido por Hans Geiger e Ernest Marsden, que conduziram uma série de experimentos usando partículas alfa e folhas de ouro – aka. o “experimento da folha de ouro”.
Nesta experiência, Geiger e Marsden mediram o padrão de dispersão das partículas alfa com uma tela fluorescente. Se o modelo de Thomson estivesse correto, as partículas alfa passariam pela estrutura atômica da folha sem impedimentos. No entanto, eles notaram que, enquanto a maioria disparou, alguns deles foram espalhados em várias direções, com alguns voltando na direção da fonte.

Geiger e Marsden concluíram que as partículas encontraram uma força eletrostática muito maior do que a permitida pelo modelo de Thomson. Como as partículas alfa são apenas núcleos de hélio (que possuem carga positiva), isso implicava que a carga positiva no átomo não estava amplamente dispersa, mas concentrada em um volume minúsculo. Além disso, o fato de que aquelas partículas que não foram defletidas passadas sem impedimentos significava que esses espaços positivos eram separados por vastos abismos de espaço vazio.
Em 1911, o físico Ernest Rutherford interpretou os experimentos Geiger-Marsden e rejeitou o modelo do átomo de Thomson. Em vez disso, ele propôs um modelo em que o átomo consistia basicamente de espaço vazio, com toda a sua carga positiva concentrada em seu centro em um volume muito pequeno, que estava cercado por uma nuvem de elétrons. Isso veio a ser conhecido como o modelo de Rutherford do átomo.
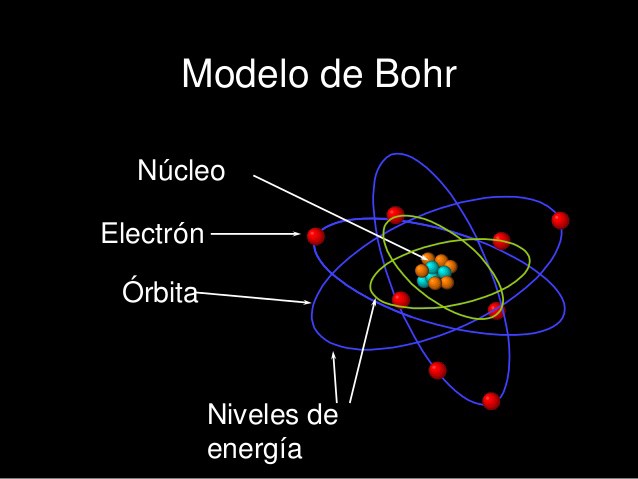
O Modelo de Bohr
Experimentos subsequentes de Antonius Van den Broek e Niels Bohr refinaram ainda mais o modelo. Enquanto Van den Broek sugeriu que o número atômico de um elemento é muito semelhante à sua carga nuclear, o último propôs um modelo do sistema semelhante ao do Sistema Solar, onde um núcleo contém o número atômico de carga positiva e é cercado por um igual número de elétrons em conchas orbitais (também conhecido como Modelo de Bohr).
Além disso, o modelo de Bohr refinou certos elementos do modelo de Rutherford que eram problemáticos. Estes incluíam os problemas decorrentes da mecânica clássica, que previam que os elétrons liberariam radiação eletromagnética enquanto orbitam um núcleo. Por causa da perda de energia, o elétron deveria ter rapidamente se lançado para dentro e colapsado no núcleo. Em suma, esse modelo atômico implicava que todos os átomos eram instáveis.
O modelo também previu que, à medida que os elétrons disparassem para dentro, sua emissão aumentaria rapidamente em freqüência à medida que a órbita se tornasse menor e mais rápida. Entretanto, experimentos com descargas elétricas no final do século 19 mostraram que os átomos emitem energia eletromagnética apenas em certas frequências discretas.
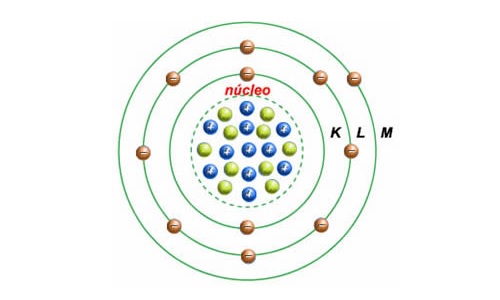
Bohr resolveu isso propondo que os elétrons orbitam o núcleo de maneiras que eram consistentes com a teoria quântica de radiação de Planck. Neste modelo, os elétrons podem ocupar apenas certos orbitais permitidos com uma energia específica. Além disso, eles só podem ganhar e perder energia pulando de uma órbita permitida para outra, absorvendo ou emitindo radiação eletromagnética no processo.
Essas órbitas estavam associadas a energias definidas, às quais ele se referia como cascas de energia ou níveis de energia. Em outras palavras, a energia de um elétron dentro de um átomo não é contínua, mas “quantizada”. Esses níveis são assim rotulados com o número quântico n ( n = 1, 2, 3, etc. ) que ele afirmava poder ser determinado usando a fórmula de Ryberg – uma regra formulada em 1888 pelo físico sueco Johannes Ryberg para descrever os comprimentos de onda das linhas espectrais de muitos elementos químicos.
Influência do Modelo de Bohr
Enquanto o modelo de Bohr se mostrou inovador em alguns aspectos – a fusão Ryberg de constante e constante de Planck (aka teoria quântica.) Com o modelo de Rutherford – ele fez sofrer de algumas falhas que mais tarde experimentos que ilustram. Para começar, supunha-se que os elétrons têm um raio e uma órbita conhecidos, algo que Werner Heisenberg recusaria uma década depois com seu Princípio da Incerteza.
Além disso, embora fosse útil para prever o comportamento de elétrons em átomos de hidrogênio, o modelo de Bohr não foi particularmente útil na previsão dos espectros de átomos maiores. Nesses casos, onde os átomos têm múltiplos elétrons, os níveis de energia não eram consistentes com o que Bohr previu. O modelo também não funcionou com átomos de hélio neutros.
O modelo de Bohr também não poderia explicar o Efeito Zeeman, um fenômeno observado pelos físicos holandeses Pieter Zeeman em 1902, em que as linhas espectrais são divididas em duas ou mais na presença de um campo magnético estático externo. Por causa disso, vários refinamentos foram tentados com o modelo atômico de Bohr, mas estes também se mostraram problemáticos.
No final, isso levaria ao modelo de Bohr ser substituído pela teoria quântica – consistente com o trabalho de Heisenberg e Erwin Schrodinger. No entanto, o modelo de Bohr permanece útil como uma ferramenta instrucional para introduzir os alunos a teorias mais modernas – como a mecânica quântica e o modelo atômico da camada de valência.
Também se revelaria um marco importante no desenvolvimento do Modelo Padrão de física de partículas , um modelo caracterizado por “nuvens de elétrons”, partículas elementares e incerteza.


