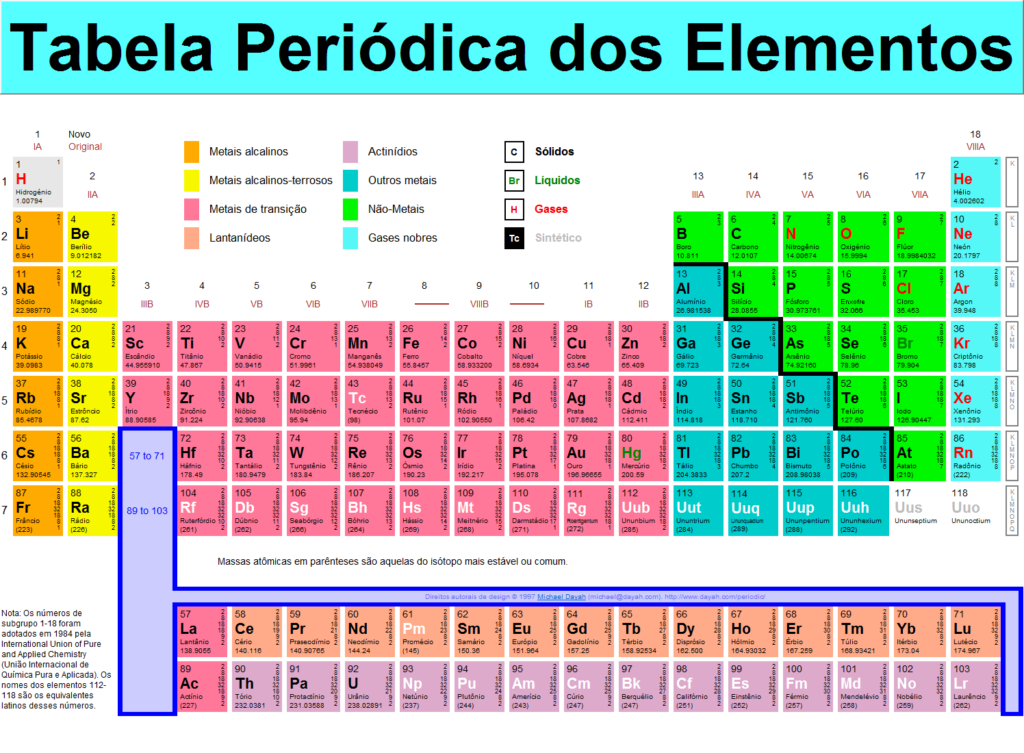
A tabela periódica de elementos organiza todos os elementos químicos conhecidos em uma matriz informativa. Os elementos são organizados da esquerda para a direita e de cima para baixo em ordem crescente de número atômico. A ordem geralmente coincide com o aumento da massa atômica. Quando os elementos químicos são assim organizados, há um padrão recorrente chamado de “lei periódica” em suas propriedades, em que elementos na mesma coluna (grupo) têm propriedades semelhantes.
As linhas são chamadas de períodos. O número do período de um elemento significa o nível de energia mais alto que um elétron naquele elemento ocupa (no estado não excitado). O número de elétrons em um período aumenta à medida que se move para baixo na tabela periódica; portanto, à medida que o nível de energia do átomo aumenta, o número de subníveis de energia por nível de energia aumenta.
Elementos que ocupam a mesma coluna na tabela periódica (chamados de “grupo”) têm configurações eletrônicas de valência idênticas e, consequentemente, comportam-se de maneira similar quimicamente. Por exemplo, todos os elementos do grupo 18 são gases inertes.

A História da Tabela Periódica
Os primeiros anos do século XIX testemunharam um rápido desenvolvimento da química analítica – a arte de distinguir diferentes substâncias químicas – e a conseqüente construção de um vasto corpo de conhecimento das propriedades químicas e físicas de ambos os elementos e compostos. Essa rápida expansão do conhecimento químico logo exigiu classificação , por sobre a classificação do conhecimento químico baseiam-se não só a literatura sistematizada de química, mas também as artes de laboratório pelo qual a química é transmitida como uma ciência viva de uma geração de químicos para outro. Relacionamentos foram discernidos mais prontamente entre os compostos do que entre os elementos; Ocorreu, assim, que a classificação dos elementos ficou muito atrasada em relação aos compostos. De fato, nenhum acordo geral foi alcançado entre os químicos quanto à classificação dos elementos por quase meio século após os sistemas de classificação de compostos terem se estabelecido em uso geral.
JW Döbereiner em 1817 mostrou que o peso combinando, significandopeso atômico , de estrôncio fica a meio caminho entre os de cálcio e bário , e alguns anos depois ele mostrou que outrosexistem tríades(cloro, bromo e iodo [halogênios] e lítio , sódio e potássio [metais alcalinos]). J.-B.-A. Dumas, L. Gmelin, E. Lenssen, Max Von Pettenkofer e JP Cooke expandiram as sugestões de Döbereiner entre 1827 e 1858, mostrando que relações semelhantes se estendiam além das tríades de elementos, sendo o flúoradicionado aos halogênios e magnésio à alcalina-terra. metais, enquanto oxigênio , enxofre , selênio e telúrio foram classificados como uma família e nitrogênio, fósforo ,arsênico , antimônio e bismuto como outra família de elementos.

Tentativas mais tarde foram feitas para mostrar que os pesos atômicos dos elementos poderiam ser expressos por uma função aritmética, e em 1862A.-E.-B. de Chancourtois propôs uma classificação dos elementos baseada nos novos valores de pesos atômicos dados pelo sistema de Stanislao Cannizzaro de 1858. De Chancourtois plotou os pesos atômicos na superfície de um cilindro com uma circunferência de 16 unidades, correspondendo ao peso atômico aproximado de oxigênio. A curva helicoidal resultante trouxe elementos intimamente relacionados para pontos correspondentes acima ou abaixo um do outro no cilindro, e ele sugeriu em consequência que “as propriedades dos elementos são as propriedades dos números”, uma previsão notável à luz do conhecimento moderno.
O “Pai” da Tabela Periódica
Dmitri Mendeleev, um químico e inventor russo, é considerado o “pai” da tabela periódica. Na década de 1860, Mendeleiev era um professor popular em uma universidade em São Petersburgo, na Rússia. Como não existiam livros didáticos de química orgânica modernos em russo naquela época, Mendeleiev decidiu escrever um, e simultaneamente abordar o problema dos elementos desordenados.
Colocar os elementos em qualquer tipo de ordem seria bastante difícil. Neste momento, menos da metade dos elementos eram conhecidos, e alguns deles receberam dados errados. Foi como trabalhar em um quebra-cabeça realmente difícil com apenas metade das peças e com algumas das peças deformadas.

Mendeleiev finalmente escreveu o livro de química definitivo de seu tempo, intitulado “Princípios da Química” (dois volumes, 1868-1870). Enquanto ele estava trabalhando nisso, ele encontrou uma descoberta significativa que contribuiria grandemente para o desenvolvimento da tabela periódica atual. Depois de escrever as propriedades dos elementos nas cartas, ele começou a encomendá-las aumentando o peso atômico. Foi quando ele percebeu certos tipos de elementos aparecendo regularmente. Depois de trabalhar intensamente nesse “quebra-cabeça” por três dias, Mendeleiev disse que tinha um sonho em que todos os elementos se encaixavam conforme necessário. Quando ele acordou, ele imediatamente os escreveu em um pedaço de papel – apenas em um lugar a correção parecia necessária, ele disse mais tarde.
Mendeleev organizou os elementos de acordo com o peso atômico e a valência. Ele não apenas deixou espaço para elementos ainda não descobertos, como também previu as propriedades de cinco desses elementos e seus compostos. Em 1869, ele apresentou as descobertas à Russian Chemical Society. Seu novo sistema periódico foi publicado no periódico químico alemão Zeitschrift für Chemie (Journal of Chemistry).

Lendo a a Tabela Periódica
A tabela periódica contém uma enorme quantidade de informações importantes:
Número atômico: O número de prótons em um átomo é referido como o número atômico desse elemento. O número de prótons define qual elemento é e também determina o comportamento químico do elemento. Por exemplo, os átomos de carbono têm seis prótons, os átomos de hidrogênio têm um e os átomos de oxigênio, oito.
Símbolo atômico : O símbolo atômico (ou símbolo do elemento) é uma abreviatura escolhida para representar um elemento (“C” para carbono, “H” para hidrogênio e “O” para oxigênio, etc.). Esses símbolos são usados internacionalmente e às vezes são inesperados. Por exemplo, o símbolo do tungstênio é “W” porque outro nome para esse elemento é wolfram. Além disso, o símbolo atômico para o ouro se “Au”, porque a palavra para o ouro em latim é aurum.
Peso atômico: O peso atômico padrão de um elemento é a massa média do elemento em unidades de massa atômica (amu). Átomos individuais sempre possuem um número inteiro de unidades de massa atômica; no entanto, a massa atômica na tabela periódica é declarada como um número decimal porque é uma média dos vários isótopos de um elemento. O número médio de nêutrons para um elemento pode ser encontrado subtraindo-se o número de prótons (número atômico) da massa atômica.
Peso atômico para elementos 93-118: Para elementos que ocorrem naturalmente, o peso atômico é calculado a partir da média dos pesos das abundâncias naturais dos isótopos desse elemento. No entanto, para elementos trans-urânio criados em laboratório – elementos com números atômicos superiores a 92 – não há abundância “natural”. A convenção é listar o peso atômico do isótopo de vida mais longa na tabela periódica. Esses pesos atômicos devem ser considerados provisórios, uma vez que um novo isótopo com uma meia-vida mais longa poderia ser produzido no futuro.
Dentro desta categoria estão os elementos superpesados, ou aqueles com números atômicos acima de 104. Quanto maior o núcleo do átomo – que aumenta com o número de prótons dentro – mais instável é esse elemento, geralmente. Como tal, esses elementos desproporcionais são fugazes, durando meros milissegundos antes de decair em elementos mais leves. Por exemplo, elementos superpesados 113, 115, 117 e 118 foram verificados pela IUPAC em dezembro de 2015, completando a sétima linha, ou período, na tabela. Vários laboratórios diferentes produziram os elementos superpesados. Os números atômicos, nomes temporários e nomes oficiais são:
- 113: unúntrio (Uut), nihonium (Nh)
- 115: ununpentium (Uup), moscovium (Mc)
- 117: ununseptio (Uus), tennessine (Ts)
- 118: ununoctio ( Uuo ), oganesson (Og)